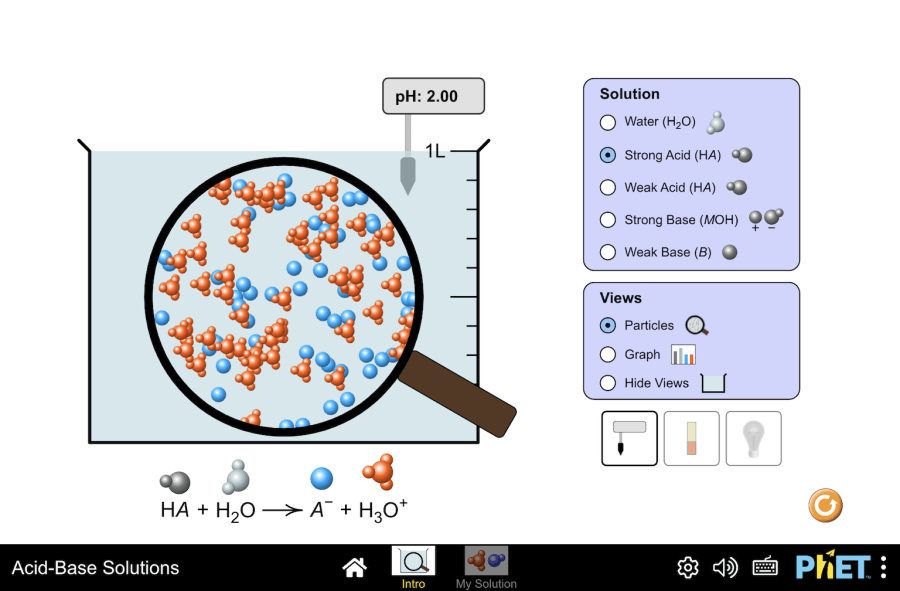
Название проекта: Электролитическая диссоциация Эта виртуальная лаборатория предназначена для использования на уроках химии по следующим темам: Цели: Практическая часть Симуляция “Acid-base solutions” от PhET – это эффективный инструмент для изучения кислот и оснований. Шаг 1. Запустите симуляцию. Для использования вам будут предоставлены два режима: “Intro” и “My solution”. Давайте протестируем первый режим. Режим “Intro” Здесь вы можете изучить свойства кислот и оснований, а также разницу между сильными и слабыми растворами. Шаг 2. На экране представлен стакан с раствором. Вы можете выбрать один из пяти растворов из списка для дальнейшего исследования. Шаг 3. Начнем с изучения сильной кислоты. Взгляните на увеличенный под микроскопом раствор. Сравните это изображение со сбалансированным химическим уравнением снизу, чтобы определить изображенные частицы. Для лучшего восприятия их относительного количества, ионы окрашены в разные цвета. Шаг 4. Теперь определите основные свойства кислот и оснований, используя инструменты симуляции. Давайте сначала взглянем на свойства сильного основания. рН раствора можно определить с помощью рН-метра или лакмусовой бумаги. Шаг 5. Электропроводность раствора можно проверить с помощью измерительного прибора. Для этого опустите электроды в раствор. Количество света, излучаемого лампочкой, помогает качественно сравнить электропроводность раствора. Чем ярче светит лампочка, тем выше электропроводность раствора. Шаг 6. Затем повторите то же самое с раствором слабого основания и водой. Сравните яркость свечения лампочки в каждом случае. Вы заметите, что лампочка ярче всего светится в растворе сильного основания, а в дистиллированной воде не светится вообще. Это подтверждает, что электропроводность сильного основания выше, чем у слабого основания, и гораздо выше, чем у дистиллированной воды. Шаг 7. Данный режим также поможет разобраться, почему кислоты и основания делятся на “сильные” и “слабые”. Рассмотрим пример сильной кислоты. График демонстрирует соотношение недиссоциированной кислоты, сопряженного основания и ионов гидрония в растворе. Чем больше недиссоциированной кислоты, тем слабее она. Соответственно, чем больше ионов гидрония, тем сильнее кислота. Шаг 8. Изучите поведение слабой кислоты, обращая внимание на изменения равновесных концентраций недиссоциированной кислоты и ее сопряженного основания. Шаг 9. Как только вы определите сильные и слабые кислоты, вы можете использовать моделирование для проверки и уточнения своих определений, сравнив сильные основания со слабыми. Режим “My solution” На этом режиме вы можете экспериментировать с созданием растворов кислот и оснований, чтобы понять разницу между их силой и концентрацией. Шаг 10. Этот экран выглядит точно так же, как и первый, и имеет все те же инструменты, но вот самая интересная часть: вы можете создавать свои собственные растворы! Это позволяет вам экспериментировать с различными начальными концентрациями и силой кислоты, чтобы увидеть, как они влияют на pH раствора. Шаг 11. Вы можете использовать экран, для проверки себя, посчитав, сколько существует способов создания раствора с определенным pH. Например, вы можете попытаться создать раствор с pH показателем 3. Поместите pH-метр в раствор и выберите радиокнопку “Graph”. Шаг 12. Один из способов создать раствор с pH 3 – установить переключатель Strength на “strong”, а начальную концентрацию на 0,001 моль/л. Вы должны заметить, что кислота полностью диссоциирована, а концентрация ионов гидроксония составляет 0,001 моль/л. Шаг 13. Чтобы создать раствор слабой кислоты с pH 3,0, увеличьте начальную концентрацию до 1,0 моль/л и поменяйте переключатель Strength на “weak”. Затем с помощью ползунка отрегулируйте рН до 3. Обратите внимание, что даже если кислота не полностью диссоциирует, концентрация ионов гидроксония снова составляет примерно 0,001 моль/л. Вы можете исследовать дополнительные способы создания растворов с pH 3, изменяя как начальную концентрацию раствора, так и силу кислоты. Данное упражнение опровергает ошибочное мнение, что pH можно использовать для определения силы кислоты или основания. На самом деле, pH является индикатором концентрации ионов гидроксония в растворе. Заключение Данная симуляция создает для учеников виртуальную лабораторию, где они могут изучить основы химии кислот и оснований. Интерактивный подход позволяет ученикам: самостоятельно исследовать свойства сильных и слабых растворов, понять связь между pH и концентрацией ионов гидроксония и научиться различать концентрацию и силу раствора. Словарь терминов