Стабильность изотопов и радиоактивный распад
Название проекта: Стабильность изотопов и радиоактивный распад Эта виртуальная лаборатория предназначена для использования на уроках химии по следующим темам: Цель виртуальной лабораторной работы: Характеристики атомных частиц Таблица 1 Массовое число частиц Число заряда Примечание протон 1 +1 Количество протонов равно порядковому номеру элемента нейтрон 1 0 Количество нейтронов можно найти по следующей формуле:N=А r -Z , А r -массовый номер атома, Z – количество протонов, электрон 0 -1 Количество электронов равно порядковый номер элемента Практическая часть 1.При запуске симуляции вы сможете выбрать один из двух режимов: “Decay” и “Chart intro”. Начнем с режима “Decay”. 2.На данном экране вы можете построить нуклид, используя протоны и нейтроны. Симуляция позволяет создавать нуклиды с количеством протонов до 94 и нейтронов до 146. Вы можете размещать протоны и нейтроны, перетаскивая их в игровую зону или же используя спиннеры. Спиннер посередине позволяет одновременно добавлять в ядро по одному протону и нейтрону. 3.По мере изменения количества нуклонов в ядре симуляция автоматически обновляет информацию: символ элемента (например. Helium -5), количество протонов и нейтронов и стабильность нуклида (Stable/Unstable) 4.Кнопка “Info” в разделе Half-life открывает статическую временную шкалу с динамическим отображением периода полураспада выбранного нуклида. 5.В рамках моделирования представлены пять типов распада: α-распад, β+ распад, β- распад, излучение протонов и нейтронов. 6.Нестабильные нуклиды распадаются на стабильные по одному из этих пяти типов распада. Виртуальный эксперимент 7.Создайте нестабильный изотоп. Например, бериллий-8. Посмотрите доступные типы распада для этого изотопа. 8.Проанализируйте символы значков распада, чтобы предсказать конечный элемент после распада. Затем нажмите кнопку, чтобы увидеть анимацию распада. 9.Понаблюдайте, как меняются: символ элемента, период полураспада, счетчик нуклонов. Определите получившийся элемент. Составьте сбалансированное уравнение данного ядерного распада. 10.Попробуйте другие изотопы с другими типами распада. 11.Вы можете нажать желтую кнопку, чтобы снова просмотреть анимацию. Определите получившийся элемент. Составьте уравнение. Заключение Данный виртуальный эксперимент эффективно продемонстрировал радиоактивный распад с помощью виртуальной симуляции PhET “Build a Nucleus”. Управляя нестабильными изотопами, ученики визуализировали процесс распада и исследовали концепцию периода полураспада. Это интерактивное исследование обеспечивает ценную основу для понимания ядерных реакций. Словарь терминов
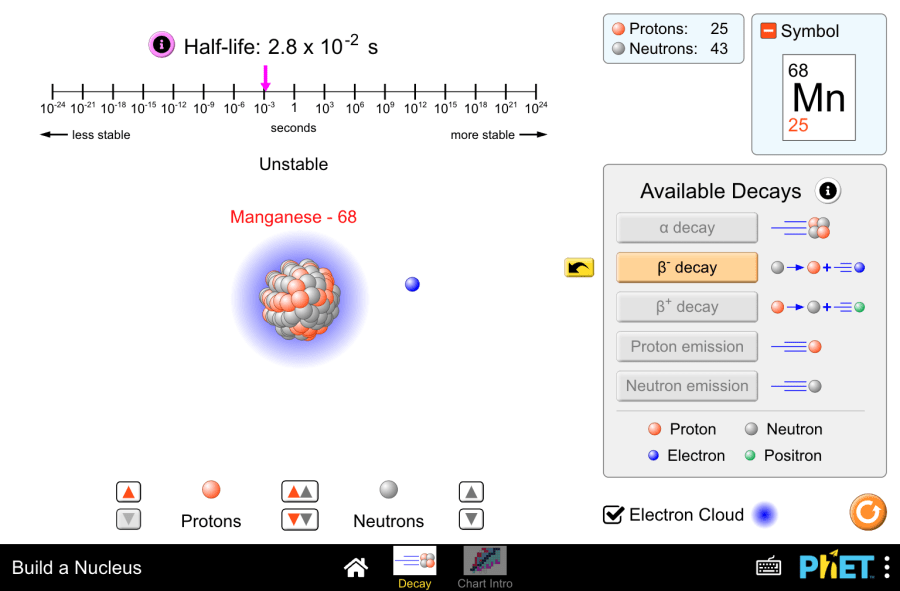
Стабильность изотопов и радиоактивный распад Читать дальше »