Изотоптардың тұрақтылығы және радиоактивті ыдырау
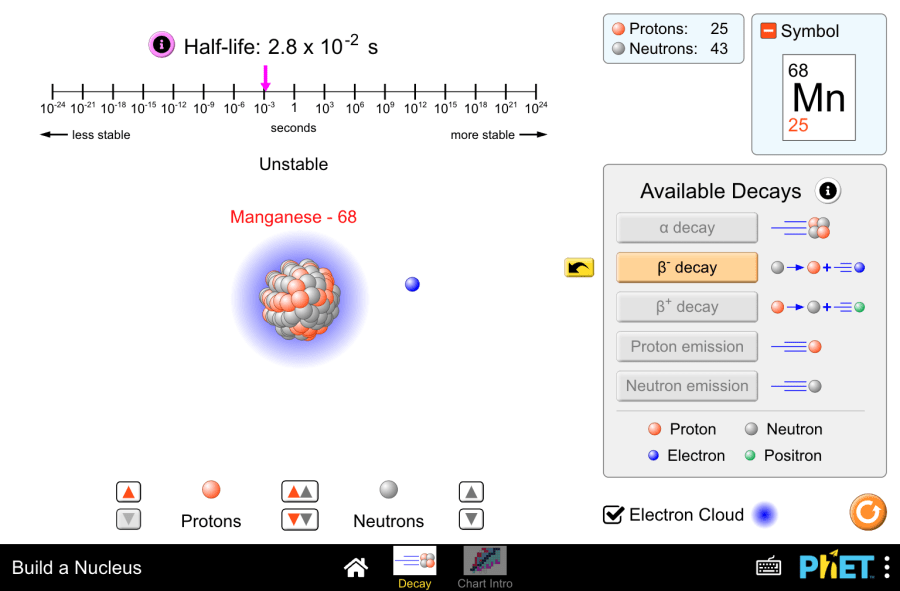
Жобаның атауы: Изотоптардың тұрақтылығы және радиоактивті ыдырау Бұл виртуалды зертхана келесі тақырыптар бойынша химия сабақтарында пайдалануға арналған: Виртуалды зертханалық жұмыстың мақсаты: Атом бөлшектерінің сипаттамалары Кесте 1 Массалық сан бөлшектердің Заряд саны Ескертпе протон 1 +1 Протондар саны элементтің реттік санына тең нейтрон 1 0 Нейтрондардың санын келесі формула бойынша табуға болады:N=А r -Z , А r -атомның массалық саны, Z – протондар саны, электрон 0 -1 Электрондар саны -ге тең реттік нөмір элементтің Тәжірибелік бөлім 1.Симуляцияны іске қосқан кезде сіз екі режимнің бірін таңдай аласыз: “Decay” және “Chart intro”. “Decay” режимін таңдаңыз. 2.Берілген экранда протондар мен нейтрондарды пайдаланып нуклид құруға болады. Симуляция протондар саны 94-ке дейін және нейтрондар саны 146-ға дейін болатын нуклидтерді жасауға мүмкіндік береді. Протондар мен нейтрондарды орталық алаңға сүйреп апару немесе спиннерлерді пайдалану арқылы орналастыруға болады. Ортаңғы спиннер ядроға бір уақытта бір протон мен бір нейтронды қосуға мүмкіндік береді. 3.Ядродағы нуклондар саны өзгерген сайын, симуляциядағы ақпарат та автоматты түрде жаңарып отырады: элемент таңбасы (мысалы,. Helium -5), протондар мен нейтрондардың саны және нуклидтің тұрақтылығы (Stable/Unstable) 4.Half-life бөліміндегі “Info” түймесі таңдалған нуклидтің жартылай ыдырау мерзімінің динамикалық дисплейі бар уақыт шкаласын ашады. 5.Симуляция аясында ыдыраудың бес түрі ұсынылған: α-ыдырау, β+ ыдырау, β- ыдырау, протондар мен нейтрондардың сәулеленуі. 6.Тұрақсыз нуклидтер ыдыраудың осы бес түрінің бірі арқылы тұрақтыға ыдырайды. Виртуалды тәжірибе 7.Тұрақсыз изотопты құрыңыз. Мысалы, бериллий-8. Осы изотоп үшін қол жетімді ыдырау түрлерін көріңіз. 8.Ыдырағаннан кейінгі түзілетін элементті болжау үшін берілген таңбаларды талдаңыз. Содан кейін ыдырау анимациясын көру үшін түймені басыңыз. 9.Элемент таңбасы, жартылай ыдырау мерзімі, нуклон саны секілді көрсеткіштердің қалай өзгеретінін бақылаңыз. Алынған элементті анықтаңыз. Берілген ядролық ыдыраудың теңдестірілген теңдеуін құрастырыңыз. 10.Ыдыраудың басқа түрлерімен басқа изотоптарды қолданып көріңіз. 11.Анимацияны қайта қарау үшін сары түймені басуға болады. Алынған элементті анықтаңыз. Теңдеу құрастырыңыз. Қорытынды Бұл виртуалды тәжірибе “Build a Nucleus” PhET виртуалды симуляциясы арқылы радиоактивті ыдырауды тиімді көрсетті. Тұрақсыз изотоптарды басқару арқылы оқушылар радиоактивті ыдырау процесін көзбен көріп, жартылай ыдырау мерзімі ұғымын зерттеді. Бұл интерактивті зерттеу ядролық реакцияларды түсінуге құнды негіз береді. Терминдік сөздік
Изотоптардың тұрақтылығы және радиоактивті ыдырау Read More »